脑血管痉挛的现代诊断和治疗
半个世纪以来,动脉瘤性蛛网膜下腔出血引起的脑血管痉挛一直是神经科学领域中的研究热点之一,现已部分解决了CVS的诊断、治疗、预防及预后等问题,但还依然存在着不少令人难以理解及亟待解决的问题。在治疗方面,CVS的病死率和残疾率由20世纪60年代的30%下降至80年代的15%。据统计,SAH患者中有12%的CVS在未治疗前就已死亡,25%于24h内死亡,另外有40%~60%的患者于30d内死亡,可见其危害之大[1]。
SAH患者转归不良的3个重要原因为:①SAH的直接结果,包括急性缺血性神经功能缺损、血肿和脑水肿;②再出血,在SAH后2周时发生率达到约20%;③CVS可造成脑缺血或脑损害,是动脉瘤破裂后引起死亡或残疾的主要原因。在动脉瘤手术或血管内治疗的技术和疗效提高的情况下,再出血的问题已得到了较好的解决,对CVS预防和处理的研究显得愈来愈重要。
1、定义
CVS已成为临床术语,专指一种特殊类型的脑动脉收缩。Mayberg定义CVS为SAH后脑底大动脉延迟出现的狭窄,常常伴有受累血管远端分布区的灌注减少。在文献上出现过的指相同情况的术语包括:SAH后血管病变,SAH的收缩性血管病变。
2、诊断方法
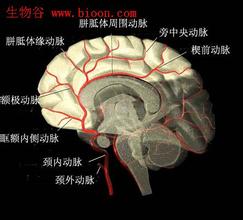
2.1脑血管造影
DSA的最大优点是能识别痉挛的血管,允许即刻进行血管成形治疗或动脉内注射血管扩张剂的治疗。但DSA也有缺点,包括患者必须离开ICU,操作的危险。
2.2CT扫描
常规CT扫描并不能直接发现CVS,但可能通过其他征象来判断发生CVS的风险。常用的CT分型标准为Fisher法,Ⅰ型:无出血发现,几乎不发生CVS;Ⅱ型:弥散的薄层SAH,厚度1mm,矢状面或横断面上面积在5mm3mm以上,CVS的发生率为96%;Ⅳ型:脑内或脑室内出血,无SAH,几乎不发生CVS。2006年Frontera提出改良的Fisher分级。0级:未见出血,CVS的发生率为3%;Ⅰ级:仅见基底池出血,CVS的发生率为14%;Ⅱ级:周边脑池或侧裂池出血,CVS的发生率为38%;Ⅲ级:广泛SAH伴脑实质内血肿,CVS的发生率为57%;Ⅳ级:基底池和周边脑池、侧裂池较厚积血,CVS的发生率为57%。灌注CT,在缺血危险区有加亮的区域,根据整个时间内对比剂的分布,可以检测脑血流。
2.3经颅多普勒超声
无必要反复做脑血管造影以发现CVS。TCD检查血流改变可发现CVS的开始和进展。MCA是最宜于TCD检查的动脉,其正常流速为30~80cm/s。脑血管造影显示有CVS者,血流速度一般都>120cm/s;若>140cm/s,则预示将发生延迟性缺血性神经功能缺损;若>200cm/s者,多数将发生脑梗死,此时,管径狭窄多已超过原管径的50%。通常将MCA起始段的血流速度与ICA颅外段相比,称为Lindigarrd比例。若此值>3,就可确定存在CVS。相似的指标用于后循环,比较颅内与颅外椎动脉的速率,以及基底动脉与颅外椎动脉的速率。通常在CVS高危险期间,即出血后3~10d,每天都需要进行TCD检测。2001年Lysakowski等报道了TCD与DSA诊断CVS的对比研究,对MCA而言,TCD的敏感性和特异性分别为67%和99%,阳性预测值和阴性预测值分别为97%和78%。TCD在评估MCA远端痉挛,与近端相比是不可靠的。在连续监测中,瞬间对瞬间的血流速度有明显可变性,故有学者对这种技术的精确性提出置疑。
2.4单光子发射计算机扫描
SPECT是另一种无侵袭的检查方法,可提供直接解剖部位的脑灌注。在延迟性缺血性神经功能障碍发生之前可发现低灌注区,发现无症状的CVS。Jabre等在研究中观察到SPECT对症状性CVS的敏感性比TCD低,但特异性比TCD高。
2.5氙增强CT/脑血流检查
XeCT比CT平扫的诊断价值高,可提供与解剖部位相应的脑血流资料。脑血流≤20ml?100g-1?min-1的区域可发生DIND,脑血流<15ml?100g-1?min-1则可能发生脑梗死。尽管这种方法有很高的诊断价值,但并不适合用于急诊的SAH患者,因为费时,患者难以配合。
2.6MRI和MRA
MRI的敏感性利于发现有可能发展成DIND的无症状性梗死患者。Shimoda等在125例SAH患者连续做MRI的研究中,发现有57%的患者迟发性缺血病变,其中一半无症状。MRA是一种能显示血管形态的无创性检查方法,但其精确性不及脑血管造影。1997年Tamatani等的研究表明,脑血管造影显示CVS的患者中有86.4%可在MRA上发现痉挛。妨碍MRA诊断CVS的原因有脑内血肿、SAH出血量较多和动脉瘤夹伪影。
2.7CTA
用电子束成像系统,或螺旋CT作连续体积薄层扫描,再将图像作三维重建,即能显示出脑动脉的形态。所得图像的清晰度接近DSA,比MRA更为逼真迅速。有学者报道,CTA与DSA在评价近端和远端动脉CVS的严重性方面高度一致。
2.8.灌注CT和MRI灌注加权成像
这两种检测脑血流的方法,可以根据特殊的放射性影像特征,显示局部灌注的不对称性,提供敏感的缺血血管分布区的线索。根据整个时间内对比剂分布,在缺血危险区显示冷色调区域,可以进行半定量测定。灌注MRI与对急性缺血敏感的弥散加权影像结合,在识别高危区时极有价值。Yavagal等的研究显示,对TCD和DSA没有CVS证据,伴有或不伴有弥散加权影像异常,又存在无法解释的临床恶化的患者,进行灌注MRI检查,可以识别和发现微血管或远端血管痉挛。在用灌注加权研究的动脉瘤性SAH患者中,发现低灌注区,与DIND有良好的相关性,并比同时进行的弥散加权的异常区更大。15例伴DIND的患者均显示灌注加权改变,而TCD发现CVS证据者仅7例
2.9.颈静脉血氧饱和度检测
有一定侵袭性检测脑血流的方法有颈静脉血氧饱和度检测和直接的脑氧检测。通常选择优势侧颈静脉,因为该侧静脉接受大多数来自脑引流的血。需要放置导管的头端在颈静脉球的嘴侧,最初的读数用同时的动脉血气和氧饱和度校准,经导管头端的光纤可以直接检测瞬间静脉氧饱和度,从中推断脑氧摄取分数、脑氧代谢率和脑血流。然而,用这种检测颈静脉氧饱和度的方法,可遗漏血管痉挛引起局部缺血的区域,故最好用脑组织氧张力探针,其优点还可同时监测颅内压。
2.10其他
脑微量渗析是一种监测缺血的神经化学标记,发现CVS和迟发性脑缺血的技术。也可结合颅内压监测,检测谷氨酸盐、乳酸及其他代谢副产物,床边酶动力学反应连续监测以筛选兴奋性毒性细胞损伤。在97例动脉瘤性SAH患者的研究中,83%的DIND患者在症状发生前就观察到提示缺血的神经化学变化。另一个研究报道显示,脑代谢的缺血类型先于DIND出现达平均11h。这些结果虽然鼓舞人心,但脑微析的使用有其局限性,包括在非常有限的组织区域得到的测量值推算的困难,导管顶端周围反应性胶质增生降低了测量的准确性,基础神经化学值的可变性,在探针置入后的组织外伤等。这些局限性不支持这种技术作为常规的诊断方式,用在动脉瘤性SAH患者中。
3、CVS的临床诊断标准
目前一般认为CVS的诊断标准为:①在SAH后5~12d发生,患者出现意识水平下降、局灶性神经功能缺损、颅内压增高、脑膜刺激征、血压升高、头痛、发热和低血钠症等,提示可能有CVS;②上述症状要排除再出血、颅内血肿、脑积水、电解质紊乱等原因;③TCD检查,MCA的血流速度>120cm/s、大脑后动脉平均流速>90cm/s,椎-基底动脉系统的血平均流速>60cm/s,即可诊断为血管痉挛。用TCD检查来监测CVS的发生,目前正在得到逐渐的重视;④脑血管造影显示颅内血管痉挛。
根据脑血管造影,CVS可分为,①弥漫性:在动脉瘤近端和远端部分血管狭窄范围达2cm以上,其中轻微者直径减少25%~50%,严重者直径减少超过50%;②周围性:在远端部分血管狭窄范围达2cm;③局限性:单个局部狭窄;④多个局限性:多个局部狭窄。
根据TCD检查的MCA的平均流速,>120cm/s为轻度CVS,中度为140~200cm/s,重度为>200cm/s。
虽然大部分学者将DIND视为CVS的直接后果,但脑血管造影所显示的CVS范围与临床症状的严重性并不完全相符,有时脑血管造影虽显示有明显的CVS,患者无临床症状,有时有严重的临床症状而血管造影无CVS。部分患者应用钙离子拮抗剂等治疗后,DSA复查发现大血管痉挛没有明显好转,但是临床缺血症状却改善了。因此,DIND的发生,不仅与CVS有关,而且与SAH后脑组织的微循环改变,包括血管的变化、血流的变化、BBB的改变以及脑代谢的情况有关。尤其微血管痉挛引起微血管内形成广泛的微栓子,造成皮层微循环障碍,可能是DIND发生的重要原因。在诊断DIND时,应考虑因其他原因引起的迟发性神经功能障碍,如脑积水、脑水肿或再出血等,故可认为DIND是由多种因素造成的。
4、CVS的防治
慢性CVS的正确处理和防止DIND的发生是决定SAH患者预后的重要因素,但CVS的治疗充满困难和挑战。由于不是单一的机制可引起CVS,故难以有计划地执行标准的治疗方案。鉴于CVS的复杂性和多因性,有必要应用不同的方法进行治疗。对SAH后3~4d开始的迟发性CVS,一旦患者有缺血症状,所有的治疗都难以奏效。因此,早期治疗显得十分必要,最好在介入或手术处理破裂动脉瘤后即刻开始。应注意目前还没有一种治疗CVS的方法无不良反应。
在理论上CVS的处理有五个方面:①在SAH后,尽早预防CVS;②在发生CVS后,纠正动脉狭窄;③预防动脉狭窄引起的脑缺血;④治疗动脉狭窄引起的脑缺血;⑤保护脑组织免受缺血损伤。后三个方面的治疗与脑缺血的内科治疗是相同的,以下重点介绍前两个方面的治疗
4.1预防CVS的方法
4.1.1防止动脉瘤形成或破裂
包括避免吸烟和吸毒,筛选危险个体中的动脉瘤并夹闭未破裂动脉瘤,诊断和治疗伴警告性渗漏的动脉瘤等。
4.1.2清除蛛网膜下腔的凝血块
如果SAH发病48h后再清除蛛网膜下腔凝血块,就不能有效预防CVS。而清除蛛网膜下腔凝血块的前提是妥善处理破裂动脉瘤,否则患者是不安全的。因此,建议最好在24h内完成血管内治疗,48h内完成手术治疗,获得早期清除蛛网膜下腔积血的时机。
机械性清除:对实施手术夹闭动脉瘤的患者,夹闭破裂动脉瘤后,用吸引器尽可能清除能显露的脑池内所有积血。
脑脊液引流:常用方法有①反复腰椎穿刺释放血性脑脊液;②脑池或脑室置管持续引流脑脊液;③腰椎穿刺置管持续引流;④枕大池置管持续引流。脑脊液引流已被证明是有效防治CVS的方法,并被广泛应用于临床。2000年,日本学者Hamada介绍了枕大池引流预防CVS的方法。其适应证为:Fisher分级为Ⅲ级,Hunt-Hess分级为Ⅰ~Ⅲ级,在动脉瘤完全栓塞后进行。2003年Hamada等的研究表明,电解可脱性弹簧圈栓塞动脉瘤后将微导管置入枕大池,6万U尿激酶+10ml等渗盐水用微泵以0.5ml/min的速度进行鞘内灌注,12h重复灌注后拔管。48h后CT复查证实基底池无血块。有症状CVS的发生率为8.9%,低于不用尿激酶组的30.2%;需要治疗的脑积水发生率为6%,低于对照组的19%。强调48h内进行枕大池引流有效。我们的临床实践表明,引流后第2天复查CT,即可观察到出血量的明显减少,血肿中央的平均CT值和引流液中血红蛋白浓度随引流时间的延长而减少。
化学性清除:常用药物为组织型纤维蛋白溶解酶原激活剂及尿激酶,用药途径目前有采用脑池、脑室、腰椎穿刺或枕大池置管注射,效果比较尚待明确。有研究表明,SAH后采用脑脊液引流尿激酶或tPA注入,可有效防治病变发展,使血管及脑组织几乎不发生病理变化,且不增加不良反应,效果更明显。维生素C尿激酶脑池灌注预防迟发性CVS也是有效的。脑池内注入抗凝剂或抗栓药物,并摇动患者头部,其目的是促进蛛网膜下腔血液的流动和再吸收,可增加疗效。
4.1.3药物预防CVS
钙通道阻滞剂:钙通道阻滞剂是目前最常用的预防CVS的药物,应用时机在SAH后急性期72h内即开始,静脉应用效果可能优于口服,对已发生的CVS无效。常用药物包括尼莫地平、尼卡地平和尼非地平。目前公认效果较好的是尼莫地平,能改善所有级别SAH伴发CVS患者的预后。尼莫地平常用剂量为2mg/h静脉输入,口服剂量为40mg/4h,连续应用2~3周。德国21个神经外科中心对123例患者用尼莫地平治疗效果显示:用6O~90mg/d,3周后停药,因脑血管痉挛所致死亡、植物状态及重残由55%降至25.9%。尼卡地平主要在日本广泛用于CVS和DIND的保护性治疗,但其引起的全身低血压比尼莫地平更加严重。
法素地尔:法素地尔为5-异喹啉磺酰胺衍生物,又名AT877或HAl077,过去认为是细胞内钙拮抗剂,现在明确是Rho激酶抑制剂,通过抑制平滑肌收缩的最终阶段――肌球蛋白轻链的磷酸化而扩张血管,可以扩张中、小动脉,改善CVS引起的脑缺血症状,是治疗CVS的另一种强效的血管扩张剂。1995年6月在日本开始应用于临床,剂型为溶液,每支2ml,含法素地尔30mg,成人剂量为30mg稀释于100ml等渗盐水中静脉滴注,于30min内滴完,3次/d,共14d。法素地尔无严重不良反应,少数患者有轻度降血压作用,大多发生于注射后5min内,降幅为2mmHg左右。法素地尔治疗CVS的疗效已经得到了双盲随机对照试验的证实。在276例SAH患者中,对于脑血管造影中的中、重度CVS,治疗组比对照组减少38%;对于有症状CVS,治疗组比对照组减少30%;对于重度残疾、植物状态和死亡等不良后果,治疗组较对照组减少54%。两组出现CVS症状的时间和再出血发生率差异无统计学意义。2006年,在法素地尔与尼莫地平的对照试验中,证实法素地尔试验组的症状性CVS发生率低于尼莫地平对照组。2007年法素地尔上市后,调查研究1995―2000年共1462例患者接受了治疗,进一步证实法素地尔疗效优于或至少相当于尼莫地平,其不良反应更少,用法更加简单。然而,该药仍有一些局限性,如脱水和作用时间短,仍不能确定在靶组织中的有效浓度和最佳输入方法。此药国内已有生产,已进行二期临床试验,结果应用法素地尔与尼莫地平比较,其疗效差异无显著性,但使用安全性和依从性方面法素地尔优于尼莫地平。
奥扎格雷钠是强大的TXA2合成酶抑制剂,能抑制TXA生成,同时促进PGI的生成,因而具有抗血小板聚集、扩张血管、增加血流量和供氧作用,在日本常与法苏地尔或其它药物联合应用于治疗CVS。注射用奥扎格雷钠,商品名莱澳,成人剂量为80mg,稀释于250ml等渗盐水或5%葡萄糖溶液中静脉滴注,2次/d,二周为一疗程。虽然,有个别报告认为其无效,但大多数研究支持奥扎格雷钠能通过抑制痉挛动脉中血小板凝聚,从而减轻CVS的严重性,增加CBF。但目前还没有多中心,对照,双盲研究证明其治疗的有效性。
其他:在药物预防CVS方面,内皮素受体拮抗剂及其合成抑制剂,促进一氧化氮合成的药物,K离子通道活化剂、血小板凝集抑制剂和血小板活化因子受体拮抗剂等,在实验中证明对CVS有效,但仍未见临床使用的报道。丝裂素激活蛋白激酶抑制剂、丝氨酸蛋白酶抑制剂、多聚二磷酸腺苷核糖多聚酶抑制剂,这些药物可能具有很好的前景。另外,药物缓释装置的应用,可有效控制局部药物的浓度,避免产生严重的不良反应,有良好的应用前途。
4.2治疗CVS的方法
4.2.1CVS高危期破裂动脉瘤的治疗
CVS期,发生动脉瘤再出血的风险较大,延期手术并不是很好的解决方法。Wikholm等比较了SAH后3~14d与0~2d进行血管内治疗的结果,发现两组的短期疗效差异无显著性,提示在CVS期进行血管内治疗并不增加危险。Murayama等报道了伴发严重CVS动脉瘤的血管内治疗结果,12例患者中优良6例、中残2例、重残3例、死亡1例。另外,CVS期血管内治疗无需打开脑池和牵拉肿胀的脑组织,不必进行控制性降压和采用临时夹阻断载瘤动脉,从而减少了脑缺血的发生。瑞金医院神经外科165例破裂脑动脉瘤患者中,有45例在SAH后4~14d接受血管内治疗,3个月时GOS评分优良37例、中残3例、重残2例、死亡3例。我们认为,对CVS期入院的SAH患者,只要微导管能通过狭窄的载瘤动脉,不管是否存在CVS,均应尽早进行血管内治疗。
脑血管痉挛常见疾病
| 疾病名称 | 所属科室 | 有哪些症状 |
|---|---|---|
| 脑血管痉挛 |
血管外科
|
头痛、慢性持续性头痛、呕吐、眩晕、恶心、脑血管痉挛
|
| 脑血管畸形 |
神经外科
|
头痛、眩晕、四肢抽搐、食管缺如、颈背疼痛、颅内出血
|
| 脑血管硬化 |
神经内科
|
头痛、轻度聋、血压高、眩晕、瞳孔异常、记忆障碍、硬化
|
脑血管痉挛症状起因相关文章
更多脑血管痉挛该如何治疗
脑血管痉挛症状导读
-
调查发现:那些长期吸烟的人,上了60岁后,大多有6个共性
你有没有注意过,小区里那些叼着烟遛弯的大爷们,十个有九个都在咳嗽?烟盒上印着"吸烟有害健康"不是没道理的,但老烟民们总爱用"隔壁老王抽到90岁"当挡箭... -
49岁大哥天天喝蜂蜜水,一年后体检,现在身体状况怎么样了?
每天清晨一杯蜂蜜水,这个习惯听起来既养生又惬意。49岁的张先生(化名)坚持这个习惯整整一年,原本期待体检报告能给自己一个惊喜,没想到结果却让他陷入了困... -
女子一旦子宫切除后,还能“同.房”吗?医生直言:前提得做好4点
那天闺蜜神秘兮兮地凑过来,压低声音问了个让人脸红心跳的问题:"听说子宫切除后就不能那个了?"看着她紧张兮兮的样子,突然意识到原来这么多女性都对这个问题... -
天气炎热,医生提醒糖尿病人:宁可渴着,也别在几种情况下猛喝水
三.伏.天里抱着水壶吨吨吨灌水,是许多人的夏.日标配。但对于血糖不稳的朋友来说,这个看似解渴的动作可能暗藏风险。当高温遇上血糖波动,喝水这件小事突然变... -
糖尿病“祸首”被揪出,不是甜食,是这“1物”,你是否爱吃?
听说隔壁张阿姨最.近血糖控制得特别好,一问才知道她把家里所有甜食都戒了。可奇怪的是,她连米饭都不敢多吃,每天饿得头晕眼花。这让人不禁疑惑:糖尿病真的只... -
高尿酸一口花生不能尝?医生提醒:不想终生躺病床,这4物要少吃
花生米配小酒是不少人的心头好,但体检报告上的尿酸值总能让人瞬间清醒。那些飘红的箭头背后,可能藏着关节里蠢蠢欲动的"小水晶"。高尿酸血症早已不是中老年人...
-
妊娠高血压可怎么治疗
妊娠高血压可通过生活方式干预、降压药物治疗、硫酸镁解痉治疗、终止妊娠等方式治疗。妊娠高血压通常由血管内皮损伤、胎盘缺血、遗传因素、免疫异常等原因引起... -
老是嗓子痒干咳是什么原因引起的
老是嗓子痒干咳可能由空气干燥、过敏反应、上呼吸道感染、胃食管反流病等原因引起,可通过调整环境湿度、抗过敏治疗、抗感染治疗、抑酸治疗等方式缓解。 1、... -
肺出血会不会一直咳血
肺出血通常不会一直咳血,但可能因基础疾病持续存在而反复发作。咳血程度与出血量、病因及治疗干预有关,主要影响因素有支气管扩张、肺结核、肺栓塞、肺癌等。... -
假性性早熟多久会消退
假性性早熟通常3-6个月可自行消退,实际时间受病因控制效果、激素水平波动、基础疾病治疗进度、个体代谢差异等因素影响。 1、病因控制 外源性激素接触停... -
小便有泡泡是什么原因
小便有泡泡可能由尿液浓缩、排尿冲击、蛋白尿、泌尿系统疾病等原因引起,可通过调整饮水习惯、尿常规检查等方式排查。 1、尿液浓缩 饮水不足或出汗过多导致... -
决明子的功效与作用及食用方法
决明子具有清肝明目、润肠通便、降脂降压等功效,主要用于目赤涩痛、头痛眩晕、便秘及高脂血症等。食用方法包括泡茶、煮粥或研末冲服。 1、清肝明目 决明子...
-
结肠多发小息肉要治疗吗
结肠多发小息肉通常需要根据息肉性质和患者情况决定是否治疗,多数情况下建议定期随访,少数情况需及时干预。结肠多发小息肉直径较小且病理检查为良性时,一般无... -
手心发白是怎么回事
手心发白可能由贫血、血液循环不良、雷诺现象、低血糖、白癜风等原因引起,可通过调整饮食、改善生活习惯、药物治疗等方式缓解。1、贫血贫血可能导致手心发白,... -
腓骨近端骨折的症状
腓骨近端骨折的症状主要有局部疼痛、肿胀、活动受限、淤血以及畸形。腓骨近端骨折通常由外伤、骨质疏松、运动损伤等因素引起,可能伴随腓总神经损伤或血管损伤等... -
月经推迟多久可能是怀孕了
月经推迟7天以上可能是怀孕了。月经推迟可能与怀孕、内分泌失调、精神压力等因素有关,建议使用早孕试纸检测或就医检查。月经周期通常为21-35天,推迟7天... -
紫癜肾炎补体激活
紫癜肾炎补体激活通常与免疫复合物沉积、补体系统异常活化有关,可能表现为血尿、蛋白尿等症状。紫癜肾炎的治疗需根据补体激活程度采取免疫调节、抗炎等措施,必... -
尿不出尿来是怎么回事
尿不出尿来可能由尿路梗阻、前列腺增生、神经源性膀胱、泌尿系统结石、尿道狭窄等原因引起,可通过导尿、药物治疗、手术治疗等方式缓解。尿不出尿来在医学上称为...
-
怎么除嘴唇上的毛
去除嘴唇上的毛发可通过剃须刀刮除、脱毛膏溶解、蜜蜡拔除、激光脱毛、电解脱毛等方式实现。毛发浓密可能与遗传、激素水平异常、多囊卵巢综合征等因素有关。1、... -
胸前长了好多痘痘是什么原因
胸前长痘痘可能与毛囊炎、痤疮、湿疹、真菌感染或过敏反应有关。常见原因包括皮脂分泌旺盛、细菌感染、衣物摩擦、出汗过多以及接触过敏原等。建议保持皮肤清洁干... -
香蕉配什么减肥效果好
香蕉搭配燕麦、西蓝花、鸡胸肉、酸奶、奇亚籽等食物有助于增强减肥效果。香蕉富含膳食纤维和钾,配合高蛋白、低热量的食物可提升饱腹感并促进代谢。需注意控制总... -
长痘了需要注意什么
长痘后需要注意清洁护理、饮食调整、避免刺激、合理用药及生活习惯改善。痤疮的发生与皮脂分泌过多、毛囊角化异常、细菌感染等因素相关,正确处理有助于缓解症状... -
做完双眼皮下眼袋浮肿是正常的吗
做完双眼皮下眼袋浮肿一般是正常的,属于术后常见反应。双眼皮手术会损伤局部组织,导致淋巴回流受阻和毛细血管通透性增加,通常1-2周内逐渐消退。术后早期浮... -
植发会生长头发吗
植发后移植的毛囊通常可以生长头发。植发手术通过将健康毛囊移植到脱发区域,毛囊存活后能正常生长毛发,但需注意术后护理和个体差异对效果的影响。植发手术主要...
脑血管痉挛医生推荐
更多-
冠状病毒感染
常见、不传染、不遗传就诊科室:呼吸内科/小儿感染内科 -
咯血
常见、不传染、不遗传就诊科室:呼吸内科/胸外科 -
筋膜炎
常见、不传染、不遗传就诊科室:骨科 -

无菌性脑膜炎
常见、不传染、不遗传就诊科室:神经内科/小儿神经内科/中医内科 -
类丹毒
常见、传染、不遗传就诊科室:传染科/皮肤科/职业病科